Захист довкілля від стійких органічних забруднювачів
Практична робота 5 "Виявлення органічних речовину харчових продуктах"
2). https://youtu.be/w0qrrHFPbF8
"Білки"
"Вуглеводи"
Виконайте завдання з теми "Спирти"
1). Зазнач об'єм вуглекислого газу, який утвориться при спалюванні метилового спирту, якщо витратилось 828 л кисню
2). Під час спалювання етанолу утворилося 851,2 л вуглекислого газу.
Зазнач масу спирту, що вступив у хімічну реакцію.
3). Визначити формулу насиченого одноатомного спирту, молекулярна маса якого становить 74.
4). При взаємодії якої речовини з етанолом утвориться бромоетан?
а) НBr б)Br2 в) KBr г) ZnBr2
5). З якими з перелічених речовин буде взаємодіяти метанол:
H2O, O2, HBr, Cl2, K, MgO, NaOH
Написати рівняння реакції, назвати утворені речовини.
6). Визначити формулу насиченого одноатомного спирту, молекулярна маса якого становить 88.
7). Складіть рівняння реакцій, за якими можна здійснити такі перетворення:
пропан – пропен – пропанол – хлоропропан
/
вуглекислий газ
24 лютого "Етен і етин"
Презентація до уроку
Всі онлайн уроки завжди будуть за посиланням:
https://us05web.zoom.us/j/6463496346?pwd=SmZmU2p5TlVvdkJ6TkRKU3RkeUVxdz09
Идентификатор конференции: 646 349 6346
Код доступа: 4sUm9Y
Працюємо за підручником:
https://drive.google.com/file/d/1MJXV9Ilp8BXCLFGiLc9HbabMeKg31JEI/view?usp=sharing
Практична робота №3
"Вплив різних чинників на швидкість хімічної реакції"
Розклад онлайн уроків (у ZOOM):
21 жовтня "Йонно-молекулярні рівняння хімічних реакцій"
Домашнє завдання: опрацювати презентацію, виконати завдання, наведені у презентації (слайди 15-17). Опрацювати параграф 12.
6 вересня "Хімічний зв'язок і будова речовин"
14 жовтня
"Ступінь електролітичної дисоціації. Сильні і слабкі електроліти. рН розчину"
Презентація до уроку
Конспекти і завдання для самостійного опрацювання:
2 грудня
"Ступінь окиснення"
Уважно подивіться запропоноване відео
приклади визначення ступенів окиснення запишіть у робочі зошити. Повторіть параграф 14.
18 листопада
Пройдіть тестування з теми "Якісні реакції на деякі йони"
https://vseosvita.ua/test/start/icm920
15 листопада
Практична робота 2
"Розв'язування експериментальних задач"
11 листопада
Практична робота 1.
Реакції йонного обміну в розчинах електролітів
По кожному досліду опишіть, які зміни спостерігалися, запишіть відповідні рівняння реакцій у молекулярній, повній і скороченій йонній формах.
8 листопада
"Якісні реакції на деякі йони"
Перегляньте відео
Запишіть у зошит рівняння запропонованих реакцій (виявлення хлорид, сульфат, карбонат-іонів).
Опрацюйте параграф 13.
З 10.00 до 21.00 пройдіть тестування з теми
https://vseosvita.ua/test/start/ohc015
18 жовтня
"Йонно-молекулярні рівняння"
Уважно перегляньте відео, запишіть у зошит всі запропоновані реакції.
Опрацюйте параграф 12, виконайте завдання 159-161.
11 жовтня
"Електролітична дисоціація кислот, основ і солей у водних розчинах"
Опрацюйте параграфи 10, 11. Виконайте (письмово) завдання 146, 147, 148.
4 жовтня контрольна робота з теми "Кристалогідрати"
https://vseosvita.ua/test/start/osd032
30 вересня: готуємось до контрольної роботи по приготуванню розчинів з кристалогідратів.
20 вересня
"Теплові ефекти, що супроводжують розчинення речовин"
Опрацюйте конспект ( вивчення нового матеріалу та розв'язування задач із застосуванням поняття про кристалогідрати)
16 вересня
"Розчинність речовин, її залежність від різних чинників"
Домашнє завдання: перегляньте відео, опрацюйте параграф 8 підручника "Хімія 9 кл." Т. М. Гранкіна.
9 вересня
"Поняття про дисперсні системи. Колоїдні та істинні розчини"
Пройдіть тестування для повторення основних питань курсу хімії 8 класу
код доступу qnu308
Опрацюйте параграф 3 підручника за редакцією О. В. Григоровича.
5 вересня
Хімічні властивості оксидів, кислот, основ, солей
Класифікація неорганічних речовин
Хімічні властивості оксидів
1. Основні оксиди взаємодіють з кислотами і кислотними оксидами за звичайних умов та амфотерними оксидами і гідроксидами при сплавленні з утворенням солей:
MgO + H2SO4 = MgSO4 + H2O
CaO + N2O5 = Ca(NO3)2
2. Більшість основних оксидів безпосередньо з водою не взаємодіють. Лише оксиди лужних металів, кальцію, стронцію та барію взаємодіють з водою, утворюючи розчинні у воді основи - луги:
Na2O + Н2О = 2NaOH
ВаО + Н2О = Ва(ОН)2
3. Кислотні оксиди взаємодіють з основами та основними оксидами, з амфотерними оксидами та гідроксидами з утворенням відповідних солей:
SO3 + 2NaOH = Na2SO4 + Н2О
SO3 + ВаО = BaSO4
3SO3 + A12O3 = A12(SO4)3
3SO3 + 2A1(OH)3 = A12(SO4)3 + 3H2O
4. Багато кислотних оксидів безпосередньо взаємодіють з водою, утворюючи кислоти:
SO2 + Н2О = H2SO3
Р2О5 + 3Н2О = 2Н3РО4
5. Амфотерні оксиди одночасно проявляють властивості основних та кислотних оксидів. Амфотерні оксиди безпосередньо з водою не взаємодіють. Відносно кислот та кислотних оксидів амфотерні оксиди поводять себе подібно до основних:
А12О3 + 3H2SO4 = A12(SO4)3 + 3Н2О
А12О3 + 3SO3 = A12(SO4)3
6. Відносно основ та основних оксидів амфотерні оксиди поводять себе подібно до кислотних. При взаємодії з водними розчинами лугів або при сплавленні з оксидами та гідроксидами лужних та лужноземельних металів утворюють відповідні солі:
А12О3 + 6NaOH + 3Н2О = 2Na3[Al(OH)6]
А12О3 + 2NaOH = 2NaA1O2 + Н2О
Властивості основ:
Властивості | Основи | |
Луги | Нерозчинні | |
Дія на індикатори | Змінюють забарвлення індикаторів | Не діють на індикатори |
Дисоціація на йони у водних розчинах | KOH = K+ + OH- Ba(OH)2 = Ba2+ + 2OH- | Дуже слабко дисоціюють на йони |
Взаємодія з: | ||
кислотами | NaOH + HCl = NaCl + H2O | Mg(OH)2 + 2HNO3 = Mg(NO3)2 + 2H2O |
амфотерними гідроксидами | NaOH +Al(OH)3 = NaAlO2 + 2H2O NaOH +Al(OH)3= Na[Al(OH)4] — у водних розчинах | — |
кислотними оксидами | Ca(OH)2 + CO2 = CaCO3| + H2O | — |
амфотерними оксидами | 2NaOH + Cr2O3 = 2NaCrO2 + H2O | — |
середніми солями | CuCl2 + 2NaOH = Cu(OH)2 + + 2NaCl | — |
кислими солями | NaOH + NaHCO3 = Na2CO3 + H2O | — |
Розклад під час нагрівання | NaOH, KOH — не розкладаються Ca(OH)2, Sr(OH)2 — розкладаються Ba(0H)2 = BaO + H2O | Mg(OH)2 = MgO + H2O
|
Хімічні властивості кислот
1. Більшість кислот — це рідини. їх розчини мають кислий смак, змінюють синій колір лакмусу на червоний, метилоранжу — на рожевий.
2. Найважливішими властивостями кислот є їх здатність взаємодіяти з основами, основними оксидами, амфотерними оксидами і гідроксидами з утворенням солі та води:
НС1 + NaOH = NaCl + Н2O
H2SO4 + CaO = CaSO4 + H2O
6HNO3 + A12O3 = 2A1(NO3)3 + 3H2O
3H2SO4 + 2A1(OH)3 = A12(SO4)3 + 6H2O
3. Кислоти взаємодіють з солями з утворенням нової кислоти і нової солі:
2NaCl + H2SO4 = Na2SO4 + 2НС1
K2S + H2SO4 = K2SO4 + H2S
4. З металами взаємодіють з утворенням відповідних солей:
Zn + 2НС1 = ZnCl2 + Н2
5. Взаємодія кислот-окисників з металами відбувається з утворенням солі, продуктів відновлення кислоти і води:
4Zn + 5H2SO4(к) = 4ZnSO4 + H2S + 4H2O
4Zn + 10HNO3(p) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Хімічні властивості солей
1. Солі ряду кислот підлягають термічному розкладу:
MgSO3 = MgO + SO2
2Cu(NO3)2 = 2CuO + 4NO2 + O2
2KC1O3 = 2KC1 + 3O2
2. Більшість солей при розчиненні у воді підлягають гідролізу:
2CuSO4 + 2Н2О = (CuOH)2SO4 + H2SO4
Na2CO3 + Н2О = NaHCO3 + NaOH
A12S3 + 6H2O = 2A1(OH)3 + 3H2S
3. Солі вступають у реакції обміну з кислотами з утворенням нової солі та нової кислоти:
FeS↑ + 2НС1 = FeCl2 + H2S
4. Взаємодія з лугами з утворенням солі і основи:
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
5. Реакція взаємодії між солями з утворенням осаду важкорозчинної солі:
AgNO3 + KI = AgI↓ + NaNO3
6. Реакції заміщення з металами:
Zn + Pb(NO3)2 = Zn(NO3)2 + Pb
7. Кислі солі взаємодіють з лугами з утворенням середньої солі і води:
NaH2PO4 + 2NaOH = Na3PO4 + 2Н2О
8. Основні солі взаємодіють з кислотами з утворенням середньої солі і води:
Bi(OH)2NO3 + 2HNO3 = Bi(NO3)3 + 2Н2О
Домашнє завдання: опрацюйте конспект, параграф 1.
2 вересня
Тема уроку: "Склад, формули і назви оксидів кислот, основ та солей. Класифікація оксидів, кислот, основ"
Класифікація речовин, що утворюють основні класи неорганічних сполук. Вам відомо, що хімічні елементи здатні сполучатися між собою. Унаслідок хімічних зв’язків, що виникають між атомами елементів, утворюються прості й складні речовини.
Тема, яку ви вивчатимете, стосується класифікації складних речовин, що утворюють чітку систему сполук. Для кожного класу цих сполук характерні певні склад, будова та властивості. Але, незважаючи на різний склад, будову та властивості, між ними існують внутрішні взаємозв’язки. Вступаючи в хімічні реакції, вони здатні до взаємоперетворень. Саме відмінність у складі й будові цих сполук зумовлює різні властивості. Тому складні речовини об’єднані у відповідні групи — класи: оксиди, кислоти, основи та солі. Класифікацію основних класів неорганічних сполук зображено схематично на рисунку 1.
Наприклад: калій оксид К2О, барій оксид BaO, алюміній оксид Al2O3.
Якщо ж у складі оксиду є елемент зі змінною валентністю, то її вказують у назві римською цифрою, узятою в дужки (рис. 3).
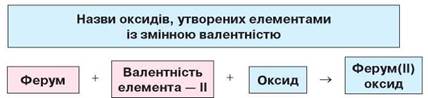
Рис. 3 Схема утворення назв оксидів, до складу яких входять елементи зі змінною валентністю
Наприклад, FeO — ферум(ІІ) оксид, Fe2O3 — ферум(ІІІ) оксид, MnO — манган(ІІ) оксид, Mn2O3 — манган(ІІІ) оксид, MnO2 — манган(ІV) оксид, Mn2O7 — манган(VII) оксид.
• На які групи класифікують оксиди?
Щоб відповісти на це запитання, знову звернемося до першої класифікації хімічних елементів на металічні й неметалічні.
• Пригадайте, як називають оксиди, утворені неметалічними й металічними елементами.
Металічні елементи утворюють з Оксигеном сполуки, які є оксидами (основними, кислотними, амфотерними), а неметалічні — кислотні оксиди.
У періодах періодичної системи є елементи, розміщені на межі між металічними та неметалічними елементами. Вони утворюють оксиди, що проявляють подвійну хімічну природу, тобто мають властивості основних і кислотних оксидів. Їх називають амфотерними. Класифікацію оксидів наведено в таблиці 1.
Таблиця 1
Класифікація оксидів
Група оксидів | Які елементи утворюють? | Приклади, подані формулами |
Солетворні оксиди | ||
Основні | Металічні (лужні, лужноземельні, Li, Na, K, Rb, Ca, Ba, Sr) | Na2O, K2O, CaO, BaO, SrO |
Кислотні | Неметалічні (S, Si, N, P, C, Cl) і металічні елементи зі ступенями окиснення +5, +6, +7 (Mn2O7) | SO3, P2O5, NO2, Mn2O7 |
Амфотерні | Ті, що в періодах розміщені на межі між металічними та неметалічними елементами (Be, Zn, Al) | BeO, ZnO, Al2O3 |
Несолетворні оксиди | ||
До групи несолетворних оксидів належать такі, що не виявляють ні основних, ні кислотних властивостей. Їх утворюють кілька неметалічних елементів. | СО, SiO, N2O, NO | |
• Користуючись даними таблиці 1, узагальніть відомості про класифікацію оксидів.
Кислоти, їхні склад, назви та класифікація. У повсякденному житті людина часто використовує кислоти. Здебільшого вони мають органічне походження: оцтова (розчин, відомий під назвою «оцет»), лимонна, яблучна, щавлева, молочна тощо.
• Оцініть значення названих органічних кислот у житті людини.
Серед великої різноманітності неорганічних сполук виділяють кислоти, що, як і оксиди, утворюють окремий клас речовин.
• Від чого, на ваш погляд, походить загальна назва цього класу речовин?
Найпоширенішими є хлоридна HCl, сульфатна H2SO4 й ортофосфатна H3PO4 кислоти. Із наведених прикладів формул неорганічних кислот бачимо, що вони містять атоми Гідрогену, які зв’язані з іншими атомами (хлоридна) або групою атомів (сульфатна, ортофосфатна). Отже, завдяки цим даним можна сформулювати визначення кислот.
З’ясуємо, з яких компонентів складаються назви кислот.

Рис. 4. Схема конструювання визначення поняття «кислоти»
Як бачимо зі схеми (рис. 45), видовими ознаками кислот є атоми Гідрогену та кислотний залишок.
Кислотний залишок — це атом або група атомів. Наприклад, хлоридна кислота містить атом Cl, сульфатна й карбонатна — групи атомів, відповідно SO4 і CO3. Характерною ознакою кислотних залишків є те, що під час хімічних реакцій вони не руйнуються.
Ознайомимося зі складом і назвами кислот, опрацювавши дані таблиці 2.
Таблиця 2
Склад і назви неорганічних кислот і кислотних залишків
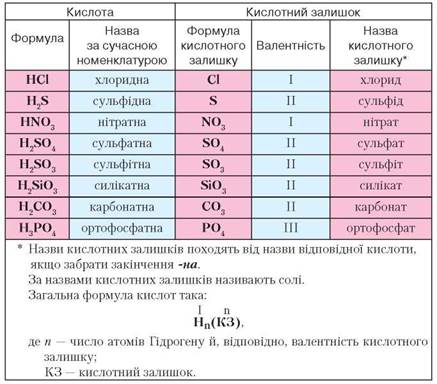
• Подумайте й поясніть, як визначити валентність кислотного залишку, знаючи валентність атомів Гідрогену.
Оскільки атоми Гідрогену одновалентні, то валентність кислотного залишку визначають за числом атомів Гідрогену в складі кислоти. З таблиці 2 стає зрозумілим походження назв неорганічних кислот.
• Поясніть це самостійно.
З аналізу хімічного складу кислот видно, що спільним для них є наявність атомів Гідрогену. Їх може бути різна кількість: один або кілька. Це вважають першою ознакою класифікації кислот. Відповідно кислоти класифікують на: одноосновні, якщо у складі кислоти наявний один атом Гідрогену; двоосновні, якщо атомів Гідрогену два; триосновні, якщо цих атомів три. Крім того, спостерігається різний склад кислотних залишків, зокрема в деяких з них наявний Оксиген, а в інших — відсутній. Це друга ознака, яку взято за основу класифікації кислот. За вмістом Оксигену чи його відсутністю в складі кислотного залишку кислоти поділяють на безоксигенові й оксигеновмісні. Отже, класифікацію кислот можна зобразити схемою (рис. 5).

Рис. 5. Схема класифікації кислот
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Складні неорганічні речовини поділяють на чотири групи: оксиди, кислоти, солі, основи.
• Оксиди — складні речовини, що містять у своєму складі два елементи, один з яких — Оксиген у ступені окиснення -2. Існують солетворні й несолетворні оксиди. Солетворні — це основні, кислотні, амфотерні оксиди.
• Назви оксидів походять від назви елемента й слова «оксид». Якщо валентність елемента є змінною, її вказують після назви елемента римськими цифрами, узявши в дужки.
• Кислоти — складні речовини, до складу яких входять один або кілька атомів Гідрогену, здатних заміщуватися на атоми металів, і кислотні залишки.
• Назви кислотних залишків відповідають назвам кислот, якщо забрати закінчення -на.
• Кислоти класифікують за вмістом атомів Гідрогену (одноосновні, двоосновні, триосновні) та за вмістом Оксигену (оксигеновмісні й безоксигенові).
Домашнє завдання: опрацювати конспект, вивчити напам'ять рис. 1-5, таблиці 1,2. Це повторення матеріалу 8 класу. Буду питати!!!


Немає коментарів:
Дописати коментар